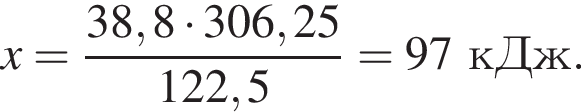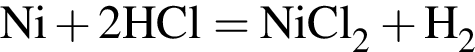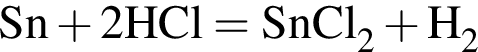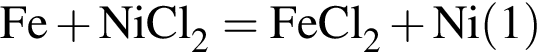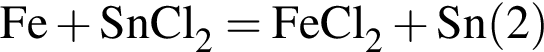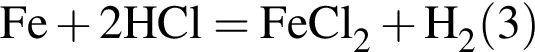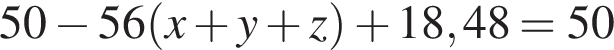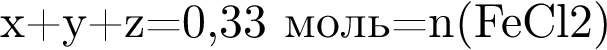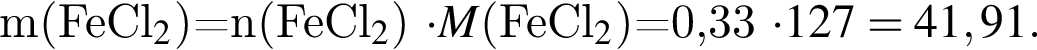Укажите название химического элемента:
1) вода
2) озон
3) азот
4) графит
Решение. Вода ![]() — это химическое соединение, которое иногда называют оксидом водорода.
— это химическое соединение, которое иногда называют оксидом водорода.
Озон ![]() — это аллотропная модификация кислорода, а графит - аллотропная модификация углерода.
— это аллотропная модификация кислорода, а графит - аллотропная модификация углерода.
А азот ![]() — это название химического элемента и вещества.
— это название химического элемента и вещества.
Правильный ответ указан под номером 3.
Ответ: 3
1202
3
Сложность: I

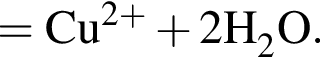 Уравнению соответствует реакция между:
Уравнению соответствует реакция между: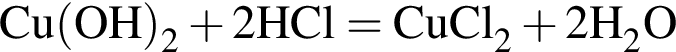
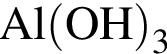 ;
;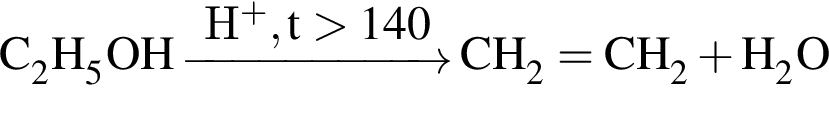
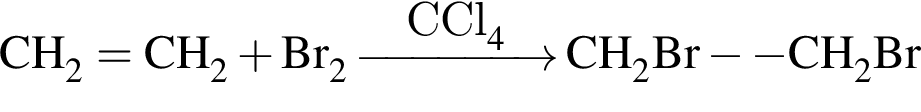
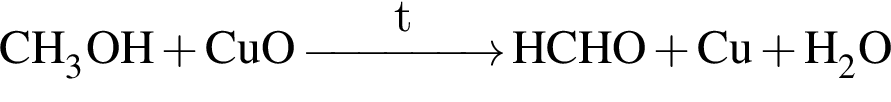

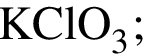
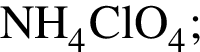
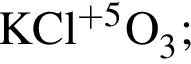
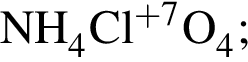
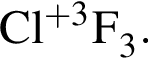
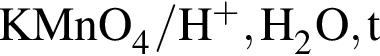
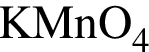 , окисляясь до уксусной кислоты. Схема реакции:
, окисляясь до уксусной кислоты. Схема реакции: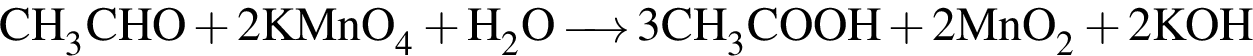 .
.
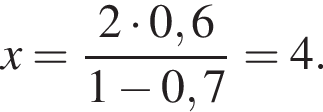
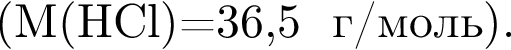
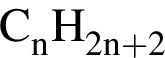

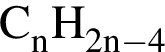
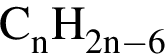
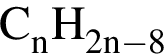
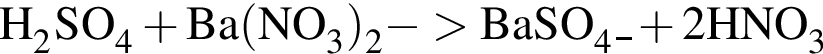
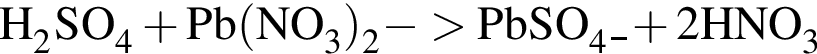
 )=x
)=x

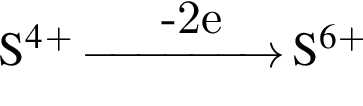
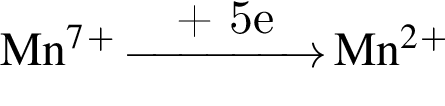
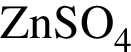 );
);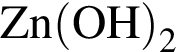 );
);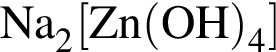 );
);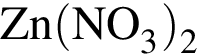 );
);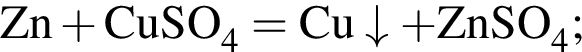
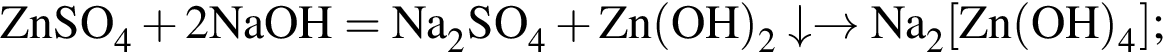
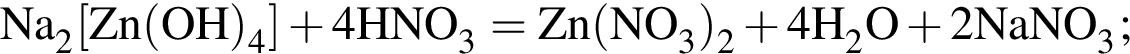
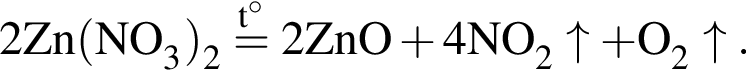
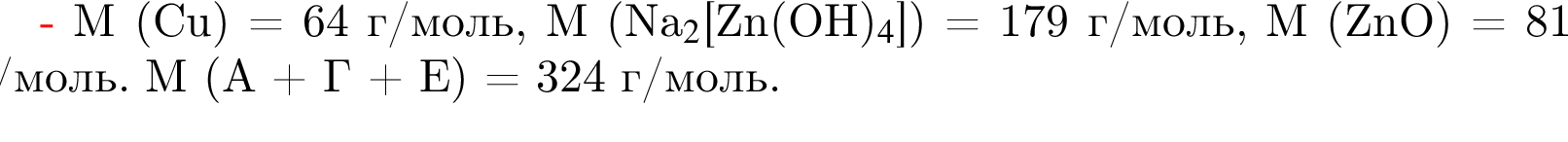
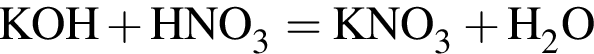
 (зеленовато-жёлтый газ)
(зеленовато-жёлтый газ)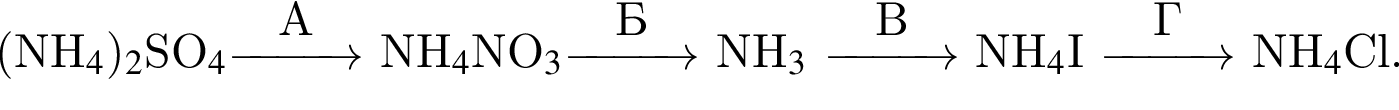
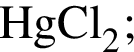

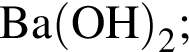

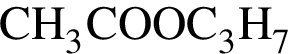 — 102 г/моль;
— 102 г/моль;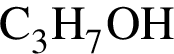 — 60 г/моль;
— 60 г/моль;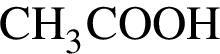 — 60 г/моль;
— 60 г/моль;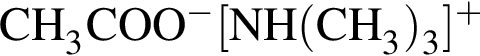 — 119 г/моль.
— 119 г/моль.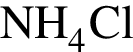 и
и 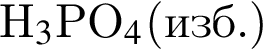
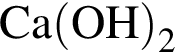 и
и 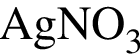 и
и 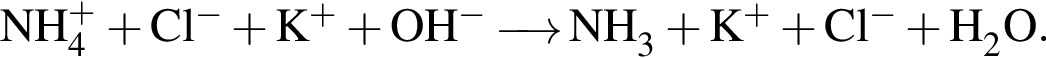 Сумма коэффициентов — 6.
Сумма коэффициентов — 6. Сумма коэффициентов — 6.
Сумма коэффициентов — 6.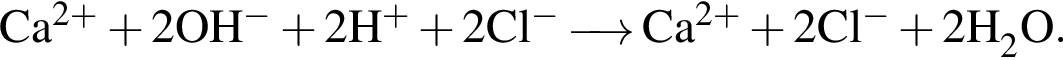 Сумма коэффициентов — 12.
Сумма коэффициентов — 12.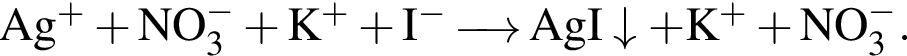 Сумма коэффициентов — 7.
Сумма коэффициентов — 7.
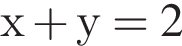
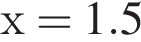 и
и 
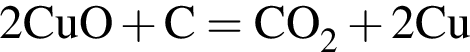
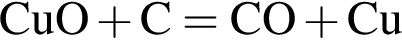
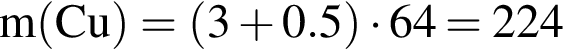 г
г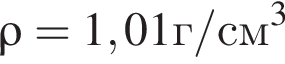 ) или уксусную эссенцию (массовая доля кислоты 70%,
) или уксусную эссенцию (массовая доля кислоты 70%,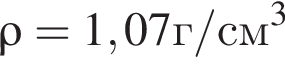 ). Для консервирования овощей требуется 275см3 уксуса. Вычислите, в каком объеме воды (см3) необходимо растворить уксусную эссенцию, чтобы приготовить раствор для консервирования.
). Для консервирования овощей требуется 275см3 уксуса. Вычислите, в каком объеме воды (см3) необходимо растворить уксусную эссенцию, чтобы приготовить раствор для консервирования.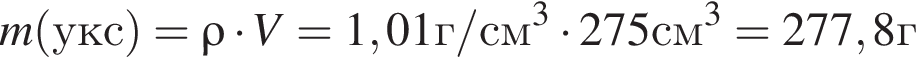


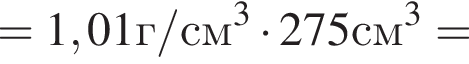


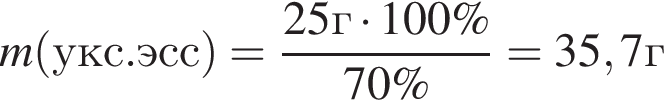
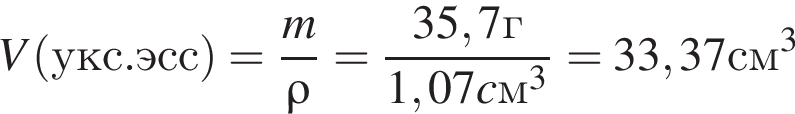
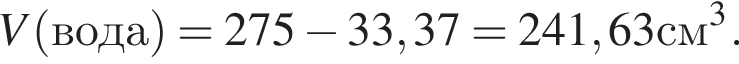 Округлив до целых, получим 242см3.
Округлив до целых, получим 242см3.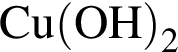 в пробирку 1 при нагревании приводит к образованию красного осадка;
в пробирку 1 при нагревании приводит к образованию красного осадка;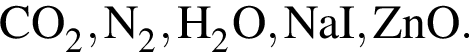 Определите число соединений, которые могут реагировать с оксидом калия.
Определите число соединений, которые могут реагировать с оксидом калия.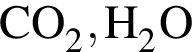 и
и 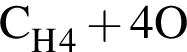 →
→ 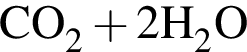
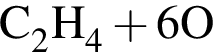 →
→ 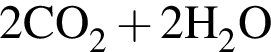
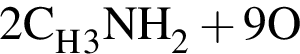 →
→ 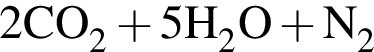
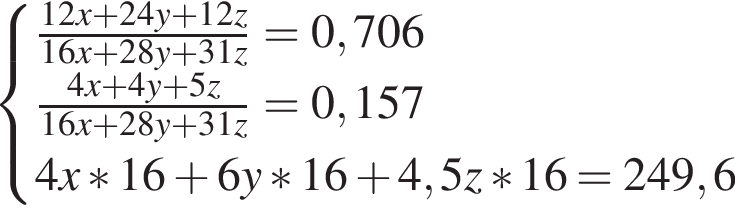
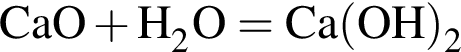
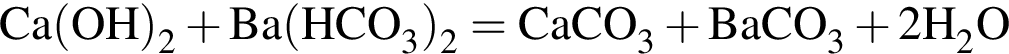

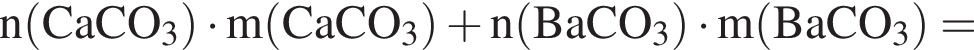

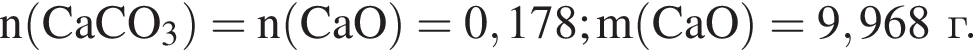

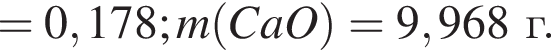
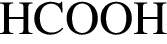
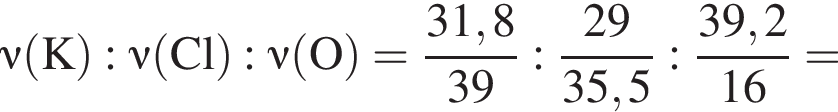
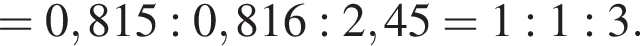

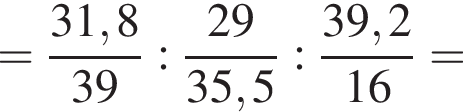
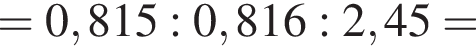
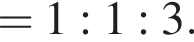
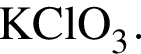 Составим пропорцию:
Составим пропорцию: